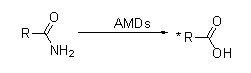
Amidase (AMD)
Enzyme:Makromolekulare biologische Katalysatoren sind die meisten Enzyme Proteine
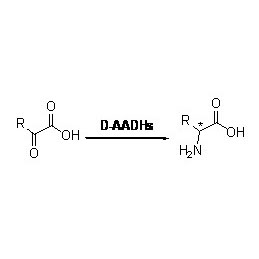
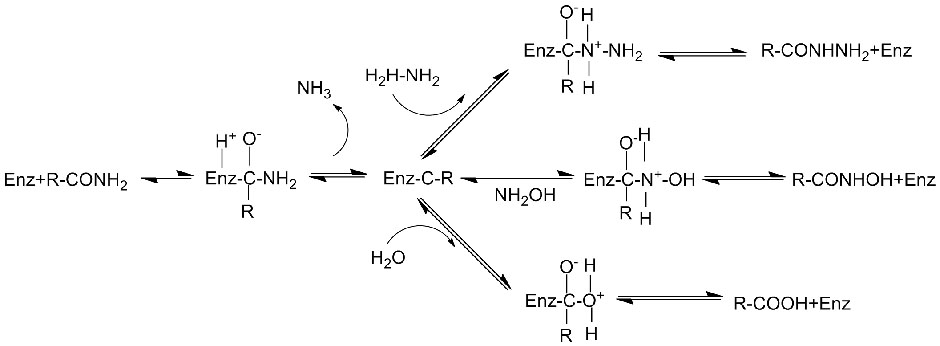
Amidase:Katalysieren Sie die Hydrolyse verschiedener endogener und fremder aliphatischer und aromatischer Amide durch Übertragung einer Acylgruppe auf Wasser unter Bildung von freien Säuren und Ammoniak.Hydroxamsäuren und andere organische Säuren werden in großem Umfang als Arzneimittel verwendet, da sie Bestandteile von Wachstumsfaktoren, Antibiotika und Tumorinhibitoren sind.Die Amidasen können gemäß der Stereoselektivität des Katalysators in Acylasen vom R-Typ und S-Typ eingeteilt werden.
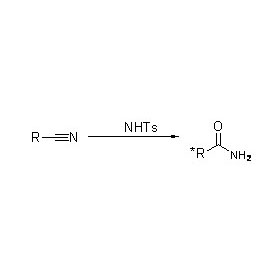
Zusätzlich zur Katalyse der Hydrolyse von Amiden kann Amidase auch Acyltransferreaktionen in Gegenwart von Co-Substraten wie Hydroxylamin katalysieren.
Amidase mit unterschiedlichen Quellen haben unterschiedliche Substratspezifitäten, einige von ihnen können nur aromatische Amide hydrolysieren, einige von ihnen können nur aliphatische Amide hydrolysieren und einige hydrolysieren α- oder ω-Aminoamide.Die meisten Amine haben nur für acyclische oder einfache aromatische Amide eine gute katalytische Aktivität, aber für komplexe Aromaten haben heterocyclische Amide, insbesondere Amide mit ortho-Substituenten, im Allgemeinen eine geringe Aktivität (nur wenige Enzyme zeigen bessere katalytische Wirkungen).
Katalytischer Mechanismus:
| Enzyme | Produktcode | Produktcode |
| Enzympulver | ES-AMD-101~ ES-AMD-119 | ein Satz von 19 Amidasen, 50 mg je 19 Stück * 50 mg / Stück oder eine andere Menge |
| Screening-Kit (SynKit) | ES-AMD-1900 | ein Satz von 19 Amidasen, je 1 mg 19 Stück * 1 mg / Stück |
★ Hohe Substratspezifität.
★ Starke chirale Selektivität.
★ Hohe Umwandlungseffizienz.
★ Weniger Nebenprodukte.
★ Milde Reaktionsbedingungen.
★ Umweltfreundlich.
➢ Aufgrund der Substratspezifität sollte ein Enzymscreening für spezifische Substrate durchgeführt werden, um ein Enzym zu erhalten, das das Zielsubstrat mit der besten katalytischen Wirkung katalysiert.
➢ Nie Kontakt mit extremen Bedingungen wie: hohe Temperatur, hoher/niedriger pH-Wert und organische Lösungsmittel mit hoher Konzentration.
➢ Normalerweise sollte das Reaktionssystem Substrat, Pufferlösung (den optimalen Reaktions-pH-Wert des Enzyms) enthalten.Co-Substrate wie Hydroxylamin sollten im Acyltransfer-Reaktionssystem vorhanden sein.
➢ AMD sollte zuletzt in das Reaktionssystem mit optimalem Reaktions-pH und Temperatur gegeben werden.
➢ Alle Arten von AMD haben verschiedene optimale Reaktionsbedingungen, daher sollte jede einzeln weiter untersucht werden.
Beispiel 1(1):
Hydrolyseaktivität zu verschiedenen Amidsubstraten
| Substrat | Spezielle Aktivität μmol min-1mg-1 | Substrat | Spezielle Aktivität μmol min-1mg-1 |
| Acetamid | 3.8 | ο-OH-Benzamid | 1.4 |
| Propionamid | 3.9 | p-OH-Benzamid | 1.2 |
| Laktamid | 12.8 | ο-NH2Benzamid | 1.0 |
| Butyramid | 11.9 | p-NH2Benzamid | 0,8 |
| Isobutyramid | 26.2 | ο-Toluamid | 0,3 |
| Pentanamid | 22.0 | p-Toluamid | 8.1 |
| Hexanamid | 6.4 | Nicotinamid | 1.7 |
| Cyclohexanamid | 19.5 | Isonicotinamid | 1.8 |
| Acrylamid | 10.2 | Picolinamid | 2.1 |
| Metacrylamid | 3.5 | 3-Phenylpropionamid | 7.6 |
| Prolinamid | 3.4 | Indol-3-acetamid | 1.9 |
| Benzamid | 6.8 |
Die Reaktion wurde in 50 mM Natriumphosphat-Pufferlösung, pH 7,5, bei 70°C durchgeführt.
| Amide | Hydroxylamin | Hydrazin |
| Acetamid | 8.4 | 1.4 |
| Propionamid | 18.4 | 3.0 |
| Isobutyramid | 25.0 | 22.7 |
| Benzamid | 9.2 | 6.1 |
Die Reaktion wurde in 50 mM Natriumphosphat-Pufferlösung, pH 7,5, bei 70°C durchgeführt.
Zugehörige Reagenzkonzentration: Amide, 100 mM (Benzamid, 10 mM);Hydroxylamin und Hydrazin, 400 mM;Enzym 0,9 μM.
Beispiel 2(2):
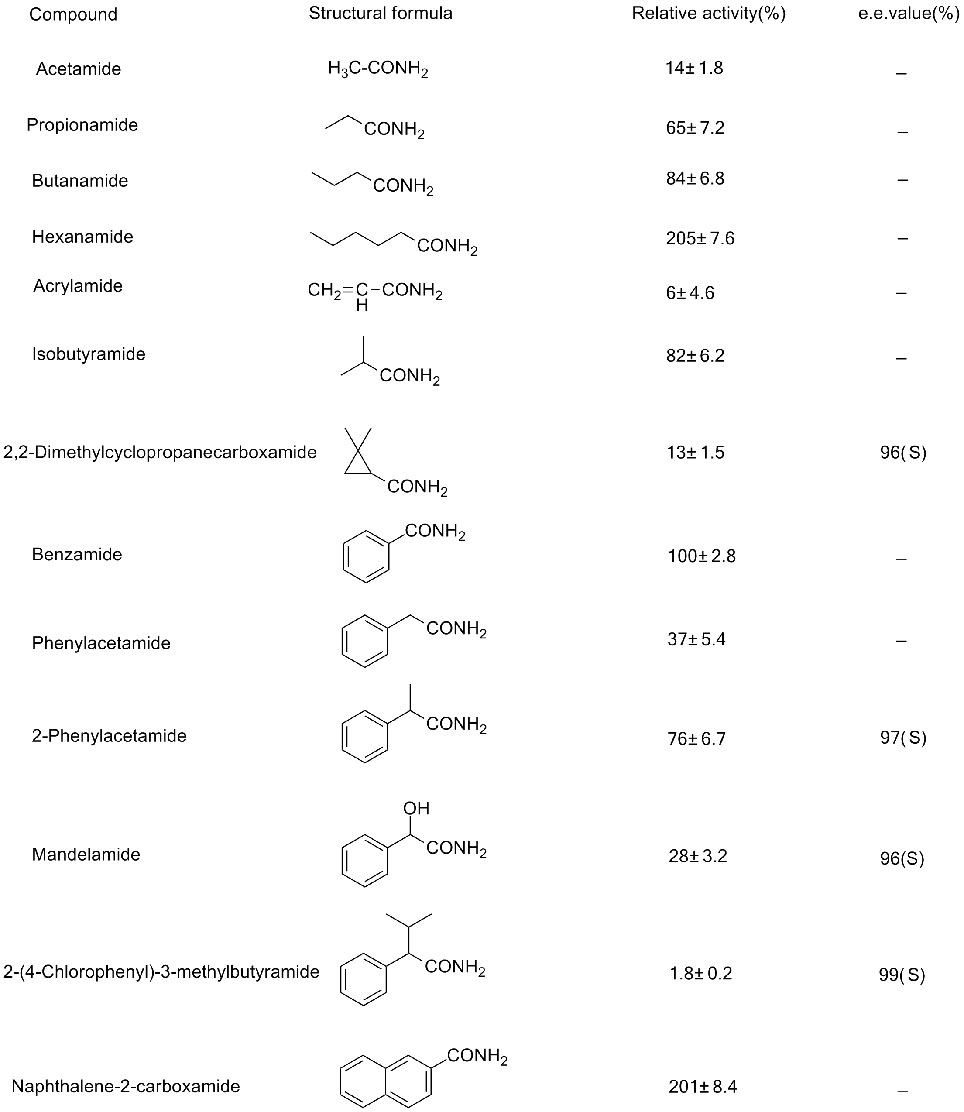
Beispiel 3(3):
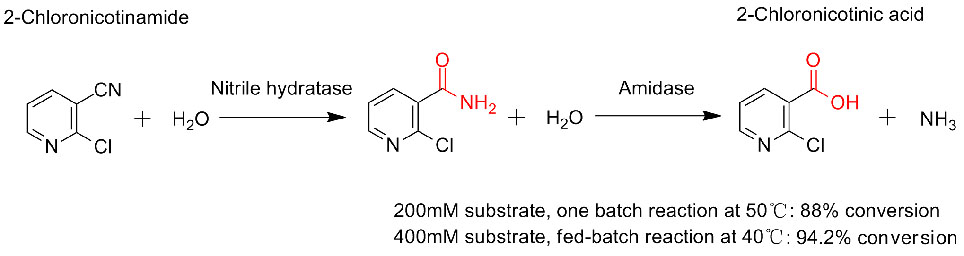
1. D'Abusco AS, Ammendola S., et al.Extremophiles, 2001, 5:183-192.
2. Guo FM, Wu JP, Yang LR, et al.Process Biochemistry, 2015, 50(8): 1400-1404.
3. RC Zheng, JQ Jin, ZM Wu, et al.Bioorganische Chemie, 2017, online verfügbar 7.